Мама-майнинг
Пять способов решить проблему стареющих яйцеклеток: от общеизвестного до фантастического

Photo by Anna Hecker on Unsplash
Средний возраст, в котором женщины рожают ребенка, в мире составляет около 30 лет. Для первых детей эта цифра, конечно, ниже — хотя в отдельных европейских и азиатских странах (вроде Италии и Южной Кореи) даже первого ребенка чаще заводят уже на четвертом десятке. К этому моменту в организме женщины остается порядка 100 000 яйцеклеток — это около 10% от того запаса, который яичники несут в себе при рождении. Остальные яйцеклетки гибнут сами по себе или теряются в ходе менструального цикла.
Но и те, что остались, просидели внутри женского тела уже несколько десятков лет — и это может сказаться на их способностях. Большую часть своей жизни яйцеклетка проводит в недоделившемся состоянии, когда ее хромосомы скручены и ждут сигнала, чтобы разойтись на два комплекта. И чем дольше они ждут, тем выше шанс, что они разойдутся неравномерно или как-нибудь порвутся в процессе. Поэтому с возрастом появляются проблемы не только в количестве яйцеклеток, но и в их качестве — те, что остались в яичниках, часто не могут дать начало жизнеспособному эмбриону, даже если сама женщина физически способна его выносить.
К 40 годам вероятность зачать ребенка естественным путем в течение года становится меньше 50%. Так что, если человечество планирует и дальше откладывать размножение на потом, ему придется научиться чинить свои яйцеклетки или добывать откуда-то новые. Рассказываем, какими способами можно было бы решить эту проблему (но не обещаем, что все они станут реальностью).
Метод, который уже работает: достать и заморозить
Один отлаженный вариант у нас уже есть — это заморозка яйцеклеток. Мы достаем их из организма женщины и, резко охлаждая, тормозим химические процессы, тем самым останавливая для них время. Замороженная яйцеклетка не накапливает дополнительных повреждений и терпеливо ждет, пока хозяйка будет готова принять ее обратно — уже в виде зародыша. Фактически это та же самая процедура, которую применяют при ЭКО, только разнесенная во времени:
- сначала гормональная стимуляция (нужна, чтобы за один цикл созрели сразу несколько яйцеклеток),
- потом пункция (созревшие яйцеклетки забирают из яичника),
- дальше заморозка,
- потом разморозка и ЭКО (но иногда замораживают и эмбрионы),
- и, наконец, перенос эмбриона в матку.
По этому методу накопилась большая статистика: его уже десять лет как перестали считать экспериментальным. Мы знаем, что это безопасно для яйцеклеток (если с ними все хорошо и их много, то эффективность даже выше 90% — то есть 9 из 10 замороженных яйцеклеток могут превратиться в новорожденных детей) и эмбрионов (здесь рисков больше, но до сих пор неясно, связаны ли они именно с процедурой или с тем, что к ЭКО чаще прибегают люди с какими-то проблемами со здоровьем).
Но важно помнить, что это не всегда безопасно (и уж точно бывает неприятно) для самой женщины. У гормональной стимуляции есть свои побочные эффекты, а некоторым людям она может быть просто противопоказана — если есть риск развития опухолей репродуктивной системы. Поэтому хорошо бы иметь альтернативу.
Метод на перспективу: забрать незрелые и дорастить
Альтернатива существует — но пока ее используют только для тех пациенток, которым запрещена гормональная терапия. У них забирают кусочек яичника прямо вместе с яйцеклетками. Но эти яйцеклетки — незрелые. Их невозможно оплодотворить сразу, для этого им нужно сначала созреть, то есть подрасти физически, накопить нужные белки, расположить определенным образом свои органеллы и внутриклеточный скелет. Их доращивают прямо в лаборатории, обрабатывая гормонами (метод называется in vitro oocyte maturation), а дальше уже переходят к оплодотворению. Эффективность такого метода ниже, чем у обычного ЭКО, — по некоторым подсчетам, около 40%.
Этот же принцип можно использовать, чтобы сохранить шанс забеременеть для пациенток с диагностированными опухолями. Химиотерапия может убить яйцеклетки, а заморозка помогает им пережить опасные времена. То есть у женщины забирают часть яичника и замораживают — а когда она закончила лечение, ткань можно разморозить и подсадить обратно, чтобы яйцеклетки дозревали, как и положено, в организме женщины. Пока эта процедура еще менее эффективна — вероятность родить после нее ребенка около 30%.
Две половинки этого метода можно совместить — чтобы ограничиться одной операцией вместо двух. Как минимум однажды французские репродуктологи уже попробовали так сделать: их пациентке нужна была химиотерапия, она хотела сохранить возможность забеременеть, но отказалась от операции по возвращению яйцеклеток. Тогда у нее взяли незрелые яйцеклетки, дорастили их в лаборатории, заморозили — а через несколько лет разморозили и оплодотворили. Один из эмбрионов подсадили пациентке, и она успешно забеременела и родила.
Теоретически, такую процедуру можно было бы проводить и для здоровых людей. Тогда от всей процедуры ЭКО осталась бы только одна операция по извлечению яйцеклеток, без гормональной терапии. Осталось только научиться это делать достаточно эффективно. Но у этого варианта, как и у предыдущего, есть важный минус — о нем нужно задуматься сильно заранее, пока яйцеклеток много и они качественные. С возрастом все они стареют — и дозревшие, и незрелые. Можно ли что-то сделать, если нужны яйцеклетки, а спохватились слишком поздно?
Метод без заморозки: омолодить постаревшие
Если в геноме яйцеклетки уже произошли какие-то серьезные мутации, то откатить их назад невозможно — по крайней мере, мы пока не научились. Но старение — это сложный процесс, который не ограничивается разрывами в хромосомах. Например, со временем в яйцеклетках начинают хуже работать митохондрии — а это значит меньше энергии для роста и развития. И производится меньше нужных белков — в том числе тех, которые удерживают вместе хромосомы. В отличие от генетических поломок, такие изменения могут быть обратимы. И у эмбриологов то и дело возникают новые идеи по поводу того, как этого добиться.
В начале 2000-х, например, они пытались вводить в старые яйцеклетки цитоплазму из молодых (так придумали пересадку митохондрий, о которой у нас был отдельный текст). В 2010-х придумали другой вариант — вводить внутрь яичника плазму крови самой женщины, обогащенную тромбоцитами.
Логика тут такая: в яичнике, помимо собственно яйцеклеток, есть еще поддерживающие клетки. Они образуют фолликул — клеточный мешочек вокруг каждой яйцеклетки — и заняты тем, что снабжают яйцеклетку питательными веществами и сигнальными молекулами. Но и самим клеткам фолликула питательных веществ может не хватать, особенно если в яичнике мало кровеносных сосудов. И вот здесь могла бы помочь плазма крови: она запускает рост новых сосудов, по ним приходит больше пищи и вспомогательные клетки фолликула лучше поддерживают яйцеклетки. Эта технология все еще не до конца изучена, но кое-где ее уже применяют в клиниках.
Кажется, проще было бы просто заменить фолликул целиком. Ученые из Сингапура недавно сделали это на мышах. Они научились культивировать целые фолликулы с яйцеклетками в лаборатории, а потом начали менять яйцеклетки местами. И оказалось, что, если пересадить старую яйцеклетку в молодой фолликул, то ее шансы созреть, оплодотвориться и вырасти в здорового мышонка растут. Хотя и остаются меньше, чем если посадить молодую яйцеклетку в молодой фолликул. Возможно, это значит, что сама старая яйцеклетка как-то негативно влияет на свое окружение.
Так что в некотором будущем можно представить себе и такую репродуктивную технологию: если женщине уже не хватает собственных молодых яйцеклеток на заморозку, можно вынуть из ее яичника старые и пересадить их в молодые фолликулы. А дальше — омоложение, созревание и ЭКО.
Осталось понять, откуда взять фолликулы. Они, например, могли бы быть донорские (это вызывает меньше этических проблем, чем донорство яйцеклеток). Или собранные в лаборатории. А если так, то, вероятно, можно вырастить и сами яйцеклетки?
Метод лабораторный: вырастить с нуля
Чтобы получить яйцеклетку из ничего, нужно решить сразу две проблемы: как добыть саму яйцеклетку и как добыть вспомогательные клетки фолликула.
Как ни странно, первая оказалась проще. Можно взять эмбриональные стволовые клетки (такие есть в зародыше на первой неделе развития) и обработать их специальным набором белков, чтобы они превратились именно в предшественники яйцеклеток. Это сделали на мышах еще в самом начале 2000-х.
У человека добыть эмбриональные стволовые клетки сложнее, но тут помогает технология репрограммирования, которую придумали японские ученые в 2006 году. Можно взять взрослую специализированную клетку, обработать ее другим набором белков (коктейль Яманаки) — и она превратится в зародышевую, которую дальше можно заставить дифференцироваться в яйцеклетку. С человеческими клетками такое получилось в 2018-м (но строго в рамках эксперимента).
Но яйцеклетки — что внутри яичника, что в пробирке — не могут нормально расти и развиваться без поддержки, то есть без фолликула. А вот его получить внезапно оказалось сложнее. В экспериментах по созданию яйцеклеток обычно фолликулы собирали из донорских клеток яичника или выращивали из клеток зародыша. Но применить это к людям в клинике невозможно: тогда каждому, кто захотел бы вырастить себе яйцеклетку, пришлось бы подбирать отдельного донора вспомогательных клеток. Значит, нужно научиться и фолликул выращивать с нуля.
А здесь возникает другая проблема: яичник — это сложная трехмерная система. И чтобы фолликул развивался нормально, недостаточно репрограммировать клетки и превратить их в клетки фолликула. Нужно еще посадить их на объемную подложку из межклеточных волокон. А еще подобрать такую систему снабжения питательными веществами, газами и жидкостью, чтобы их циркуляция напоминала то, что происходит в живом яичнике, и клетки ни в чем не нуждались. Пока это удалось сделать только однажды — японским ученым, несколько лет назад. И только для мышиных фолликулов.
Но в перспективе это было бы идеальным решением большинства наших проблем с размножением. Не нужна гормональная стимуляция, не нужна операция по поимке яйцеклеток. Достаточно только сдать свои взрослые клетки — из какой-нибудь ткани, какую не жалко, вроде кожи или жира, — и получить на выходе готовый эмбрион.
Бонусный метод: вырастить из мужских клеток
А что если кто-то очень хочет обзавестись собственной яйцеклеткой, но не может — потому что генетически он мужчина? У японских ученых есть решение и для этой проблемы. В 2023 году они получили первых в мире мышат от двух самцов. А сделали это так:
- взяли клетки самца мыши и репрограммировали их в зародышевые;
- долго размножали, дожидаясь, пока некоторые клетки при делении случайно потеряют Y-хромосому (такое нечасто, но бывает — причем и во взрослом организме, и у людей — потому что она самая маленькая);
- отобрали эти клетки и обработали их веществом, которое тормозит расхождение хромосом при делении;
- клетки продолжили делиться, но при этом получались мутанты с разным количеством хромосом;
- из них отобрали те, в которых случайным образом при делении не разошлась Х-хромосома, — то есть фактически они стали женскими, с генотипом ХХ.
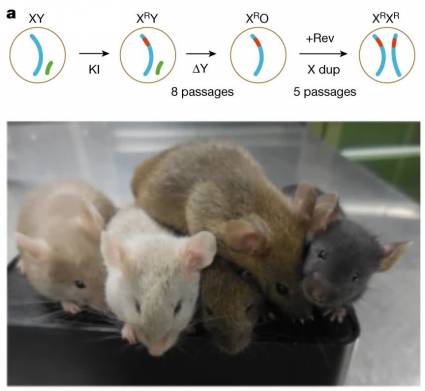
А дальше по уже отработанному протоколу эти клетки с лишней Х-хромосомой превратили в предшественники яйцеклеток и подсадили в фолликулы (в этом эксперименте брали вспомогательные клетки из яичника мыши, чтобы не множить сложности, но теоретически можно было бы использовать и искусственный фолликул из предыдущего эксперимента). В результате получились полноценные яйцеклетки, их оплодотворили сперматозоидами от другого самца мыши — и на свет появились несколько здоровых и плодовитых мышат.
Сложно представить себе, что это в ближайшее время повторят на людях, — в силу не только этических, но и технических ограничений, — но когда и если мы станем к этому готовы, уже хотя бы понятно, какой дорогой можно идти.
Спрей для сна, соцсеть только для ИИ и искусство выключаться
10 полезных ссылок от Reminder
Разрешено законом, запрещено ВкусВиллом
Гид по пищевым добавкам: как торговая сеть определяет, что может содержаться в продуктах на полках
От 20 до 80: пошаговый гид по тренировкам для долголетия
Как меняются правила фитнеса с возрастом


