Поделиться энергией. Кому может помочь пересадка митохондрий
Сейчас это довольно редкая процедура. Но что, если ее значимость выйдет за рамки сложных медицинских случаев?

Иллюстрация создана DALL-E и отредактирована человеком
Если у человека отказывает сердце, можно пересадить ему новое. Конечно, хотелось бы обойтись чем-нибудь попроще — кусочком ткани или отдельными клетками. Но врачи пошли еще дальше и пробуют пересаживать даже не целые клетки, а их части — митохондрии.
Почему именно их? Во-первых, потому что это самая самостоятельная из клеточных органелл. Когда-то она была вольной бактерией и сохранила с тех пор собственную ДНК и независимость от жизненного цикла остальной клетки.
Во-вторых, потому что это одна из самых влиятельных клеточных органелл. Наиболее известная ее задача — помогать клетке превращать питательные вещества в единую энергетическую валюту (аденозинтрифосфорную кислоту, АТФ). Но чем дальше, тем больше новых способностей у нее обнаруживается, а значит, тем длиннее список болезней, при которых она могла бы быть полезна. Начав с восстановления сердечной мышцы, биологи постепенно придумывают все больше потенциальных применений для митохондриальных трансплантатов. Среди них — воспаление мышц, легочная недостаточность, болезнь Паркинсона, депрессия и, возможно, даже старение. Есть только один подвох: в большинстве случаев до конца не ясно, как именно этот метод работает.
Как до этого додумались?
Впервые ученые опробовали пересадку митохондрий еще в начале 1980-х годов — но в сугубо исследовательских целях. Это было время молекулярно-технологического бума: клонированные клетки, синтетические ДНК, первые ГМО. На этом фоне двое генетиков из Техаса, Майк Кларк и Джерри Шэй, задались целью сделать митохондриальную химеру, то есть клетку с наборами генов разного происхождения — в конце концов, внутри митохондрий тоже есть гены, целых 37. Ученые пересадили митохондрии из одной мышиной клетки в другую и обнаружили, что они там успешно приживаются. Но лечить кого бы то ни было таким способом Кларк и Шэй не предлагали, пересадка интересовала их просто как еще один инструмент для генетических манипуляций. Поэтому людям митохондрии впервые пересадили сильно позже и совершенно случайно.
В середине 1990-х американский доктор Жак Коэн придумал способ вылечить женское бесплодие. Для этого в яйцеклетки женщин, у которых долго не получалось забеременеть, он впрыскивал небольшую часть цитоплазмы, которую забирал из яйцеклеток молодых женщин-доноров. А потом оплодотворял обработанную яйцеклетку сперматозоидами будущего отца, как при обычном ЭКО. Коэн не знал, какие именно вещества из «молодой» цитоплазмы повышают шансы яйцеклетки на оплодотворение, и даже не собирался это выяснять. Он лишь следил, чтобы внутрь иглы не попали ядерные хромосомы донора и не смешались с хромосомами матери.
К 2000 году методика Коэна помогла появиться на свет 16 детям, и он опубликовал отчет об их здоровье. Дети нормально развивались и не вызывали беспокойства у врачей. Но Коэн заметил в их клетках чужие гены, которые не встречались у матери или отца: это была ДНК из митохондрий, попавших в материнскую яйцеклетку вместе с инъекцией цитоплазмы. А поскольку митохондрии — основной производитель энергии для клетки (в виде АТФ), то не исключено, что именно они и помогли зародышам развиваться. Впрочем, это до сих пор никто не выяснил наверняка.
Сам врач не считал, что совершил что-то предосудительное. В конце концов, это всего 37 генов — по сравнению с 20 000 в ядре, — которые не могут существенно повлиять, например, на внешность или характер ребенка. Но сам факт появления на свет детей с генетическим материалом от трех человек вызвал этические дебаты: приемлемо ли это? Можно ли это считать генетической модификацией человека? Или новым шагом в сторону евгеники? Не выдержав пристального внимания американских властей, Коэн перенес свои эксперименты в Китай. А там его конкурент, Джон Чжан, придумал делать все наоборот: не впрыскивать донорскую цитоплазму в яйцеклетку матери, а пересаживать материнские хромосомы в донорскую яйцеклетку, лишенную ядра.
Как это работает. Сейчас перенос ядер существует в двух вариантах.
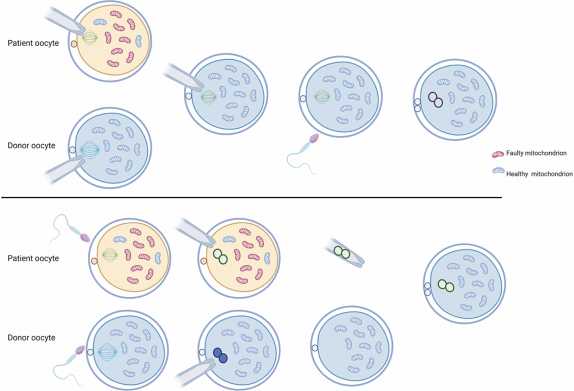
Наверху — перенос веретена: из яйцеклетки пациента (желтая) в яйцеклетку донора (голубая) переносят хромосомы (зеленые), а потом оплодотворяют сперматозоидом. Донорские хромосомы (синие) заранее убирают.
Внизу — перенос пронуклеусов: сначала обе яйцеклетки оплодотворяют сперматозоидами отца, а потом переносят хромосомы отца и матери вместе (пронуклеусы, тоже зеленые). Цель у обоих методов одна и та же — избавиться от материнских поврежденных митохондрий (красные), оставив только донорские. Источник
Эту технологию назвали переносом ядер и используют до сих пор, только не против бесплодия, а для лечения митохондриальных болезней — тех, что вызваны мутацией в митохондриальной ДНК. Поскольку митохондрии помогают клеткам получать энергию из пищи с участием кислорода, то дефекты в их работе сказываются на множестве тканей сразу, и в особенности на тех, где идет активный аэробный обмен веществ. Поэтому могут пострадать глаза, почки или мышцы, или, например, одновременно поджелудочная железа и органы слуха. Если женщина несет в своих клетках митохондриальную мутацию, то она передаст ее по наследству всем своим детям, поскольку отцовские митохондрии при оплодотворении в яйцеклетку не попадают. Так что перенос ядер, при котором ребенок получает митохондрии от донора, может быть единственным шансом для такой женщины родить здоровое потомство.
Но из-за того, что при этом получается «ребенок от трех родителей» (народное название, которое очень не любят сами эмбриологи — поскольку вклад третьего «родителя» все-таки несопоставим с остальными двумя), репутация у переноса ядер все равно неоднозначная. В некоторых странах — например в США — он официально запрещен. В других — как в Великобритании — на каждый случай нужно получать отдельное разрешение. Поэтому чаще всего дети от трех родителей появляются на свет в странах с более либеральным законодательством в области медицины — например в Мексике или восточной Европе.
Технологии уже двадцать лет, и эмбриологи все еще пытаются ее усовершенствовать, чтобы гарантировать, что материнские органеллы не достанутся зародышу. Тем временем другие ученые ищут способы чинить митохондрии в организме уже родившихся людей. Оказалось, что в некоторых случаях не обязательно заменять все органеллы в теле на здоровые, а достаточно пересадить только небольшую партию работоспособных митохондрий.
Кому еще это может пригодиться?
Вариантов здесь очень много. Например, это могут быть дети, у которых митохондриальные мутации появились de novo. То есть их матери здоровы, а митохондрии «испортились» где-то уже на стадии яйцеклетки или раннего эмбриона. Так бывает с крупными делециями — потерей сразу нескольких митохондриальных генов (например, по этому механизму развиваются синдромы Пирсона и Кернса — Сейра). Развивается типичная митохондриальная болезнь: клеткам не хватает энергии, страдают почки и эндокринные железы, ребенок отстает в развитии. Для таких случаев ученые придумали удобное решение: ребенку можно пересадить митохондрии от собственной матери и избежать таким образом этических сомнений.
Делают это так: у матери и у ребенка забирают кровь. Оттуда выделяют клетки: у матери — часть лейкоцитов, у ребенка — кроветворные стволовые клетки. Дальше материнские клетки разрушают, центрифугируют, отбирают фракцию с митохондриями и обрабатывают ей стволовые клетки ребенка. Потом их возвращают обратно в кровоток, а дальше клетки сами мигрируют по организму, снабжая «здоровой» кровью разные органы. Этот метод наращивания митохондрий (mitochondrial augmentation therapy) пока проверяют в отдельных испытаниях, но есть данные о том, что он облегчает симптомы митохондриальных болезней у детей. Таким образом нельзя, конечно, исправить уже возникшие патологии, но можно затормозить болезнь и ускорить развитие ребенка.
Похожая схема может сработать и для тех, у кого клетки (а вместе с ними и митохондрии) пострадали не по всему телу, а на отдельном участке — например при инфаркте. Нехватка кислорода сказывается на митохондриях напрямую: они раздуваются, теряют обычную форму и структуру, накапливают мутации в ДНК и перестают эффективно работать. Что можно сделать: вырезать небольшой кусочек из какой-нибудь другой, не пострадавшей мышцы или вообще из печени (обе ткани богаты митохондриями), выделить митохондрии и ввести прямо в пораженную ткань или в ближайший кровеносный сосуд. Эффект появляется уже через пару часов — очаг повреждения больше не растет, мышца начинает сокращаться лучше.
Кроме инфаркта, это может быть и инсульт, и ишемия конечностей (когда из-за закупорки сосуда там заканчивается кислород), и воспаление мышцы, и острое поражение легких. Есть идея таким образом обрабатывать донорские сердца перед пересадкой — чтобы клетки в сердечной мышце лучше переносили ожидание. Или даже лечить инфекции — поскольку лимфоцитам в острой фазе воспаления тоже необходима энергия, то можно подбросить им митохондрий, чтобы усилить иммунный ответ на сепсис или хронический туберкулез.
Но и это еще не все. Строго говоря, митохондрии нужны клеткам не только для того, чтобы поставлять энергию. На самом деле, сырье, которое митохондрия получает из цитоплазмы (остатки глюкозы), проходит через длинную цепочку реакций (цикл Кребса, о нем подробнее здесь), прежде чем его можно будет использовать для производства АТФ. В ходе этих реакций получается много побочных продуктов, их можно использовать для синтеза других полезных веществ: например аминокислот, нуклеотидов или даже гормонов. Именно митохондрии производят для нейронов ацетилхолин и мелатонин, а для клеток надпочечников — стероиды.
Кроме того, поскольку митохондрия обладает ценной информацией о том, сколько у клетки энергии и много ли ее еще можно получить в ближайшем будущем, она может об этом сигнализировать. Поэтому митохондрии могут запускать процесс клеточного самоубийства (апоптоз) или самоубийства в миниатюре (аутофагия, то есть переваривание отдельных частей клетки для высвобождения ресурсов), или регулировать дифференцировку клеток (превращение стволовых клеток в более специализированные). Так что митохондрии — это не просто клеточные электростанции, а сигнальный хаб, инфраструктура, проникающая во все области клеточной жизни. Что-то больше напоминающее банковскую систему — от которой зависят и благосостояние, и быт, и экономическое развитие, и, в какой-то степени, политический курс.
Неудивительно, что, чем длиннее становится список ролей, которые может играть митохондрия, тем больше болезней или патологических состояний ученые связывают с нарушением ее работы. Это не только острые повреждения, вроде инфаркта, но и хронические заболевания, типа диабета. Не только проблемы с периферическими тканями, вроде почек или мышц, но и нервная система — уже есть свидетельства того, как митохондрии связаны с проявлениями социальности, депрессией, когнитивными функциями, болезнями Альцгеймера и Паркинсона. Есть и митохондриальные теории старения: например, некоторые ученые полагают, что именно мутации, которые постепенно накапливаются в митохондриальной ДНК, снижают эффективность работы органелл и, следовательно, отдельных клеток и целых тканей.
Это означает, что теоретически людям со всеми вышеперечисленными состояниями и патологиями — то есть, в принципе, каждому из нас — рано или поздно могла бы понадобиться пересадка митохондрий. Осталось только понять, поможет ли она.
Почему это может сработать?
Несколько лет назад американец Мартин Пикар и швейцарка Кармен Санди предложили рассматривать человеческие митохондрии как социальные органеллы. В конце концов, когда-то давно они были свободно живущими бактериями — а бактерии умеют образовывать колонии и коммуницировать друг с другом. С тех пор митохондрии потеряли почти все свои гены, которые мигрировали в клеточное ядро, но кое-какие следы независимости все-таки сохранили.
Во-первых, они могут сливаться друг с другом и расходиться обратно — и этот процесс никак не связан с делением клетки. Обычно митохондрии сливаются друг с другом, когда у клетки возрастает запрос на энергию — крупные цепочки работают эффективнее, чем отдельные органеллы. Или же митохондрии могут конкурировать между собой за выживание внутри клетки (так, видимо, бывает в клетках «детей от трех родителей»).
Во-вторых, подобно социальным организмам, они освоили специализацию и разделение труда. Митохондрии из разных тканей легко отличить даже на вид в микроскоп — маленькие и круглые в жировых клетках против длинных и ветвистых в дендритах нейронов. Их функции, помимо производства АТФ, тоже зависят от ткани, хотя бы в том, что касается синтеза нейромедиаторов, гормонов и других сигнальных веществ.
В-третьих, митохондрии умеют собираться в группы и координировать свою активность. Где-то они просто скапливаются в определенных областях клетки, а в некоторых тканях, вроде сердечной мышцы или слюнной железы, — даже пробрасывают мостики к митохондриям из соседней клетки, чтобы обмениваться ионами и синхронизировать свои производственные процессы.
Из этого следует, что митохондрии — будь они даже не в полной мере самостоятельны и социальны — должны уметь общаться друг с другом. И действительно, таких примеров у биологов уже накопилось множество. Известны случаи, когда клетки передают друг другу митохондрии через тонкие цитоплазматические туннели. Таким образом, например, клетки соединительной ткани в легком поддерживают клетки альвеол при остром повреждении. Или же клетка может выбросить наружу вакуоли с митохондриями внутри — чтобы другая клетка их поглотила. Так ведут себя астроциты, вспомогательные клетки в нервной системе, «подкармливая» нейроны после инсульта.
Точно так же, судя по всему, поступают и жировые клетки, и мезенхимальные стволовые, и даже тромбоциты (хоть они и не клетки в строгом смысле этого слова). По крайней мере, в крови человека ученые неоднократно встречали митохондрии, которые свободно плавали и дышали (то есть потребляли кислород и производили АТФ) сами по себе. Так что, пересаживая митохондрии, мы просто эксплуатируем естественную систему коммуникации между ними. Неизвестно только, насколько эффективно мы можем ее возглавить.
Главный вопрос к пересадке митохондрий состоит в том, что до конца непонятно, как именно она работает. Большинство известных механизмов исследованы in vitro, но проследить их внутри живого организма, особенно человеческого, очень сложно.
Допустим, мы ввели митохондрии в кровь пациенту — что с ними будет дальше? Сколько времени они проживут в кровотоке, успеют ли достичь поврежденной ткани и попасть внутрь клеток?
Здесь можно возразить, что, так или иначе, врачи видят изменения в состоянии пациентов, а значит, митохондрии как-то справляются со своей задачей. Но как именно? Допустим, клетка поглотила новую органеллу, заключив ее внутрь мембранного пузыря. Дальше возможны варианты: может быть, митохондрия остается жить в заточении, не участвуя в дыхании клетки. Как минимум в одном эксперименте такой механизм уже обнаружили. Оказалось, что даже заключенные в мембрану митохондрии могут запустить в клетке аутофагию, — при этом клетка начинает переваривать свои собственные пострадавшие митохондрии, а уцелевшие могут поделиться и таким образом повысить эффективность клеточного дыхания. А может быть, митохондрия как-то выбирается из своего пузыря (но не очень понятно, как именно) и начинает дышать вместе с остальными органеллами. Или отправляется путешествовать дальше: например, клетка может передать ее по цитоплазматическому туннелю соседям.
От ответов на эти вопросы зависят требования, которым должны будут соответствовать митохондрии-кандидаты на пересадку. Если, скажем, выяснится, что митохондрии поселяются в новых клетках надолго, то главным станет вопрос совместимости. Помимо того, что белки донорской митохондрии не должны вызывать острого иммунного ответа, есть еще проблема совместимости с ядром: ученые подозревают, что не все митохондриальные геномы хорошо сочетаются с некоторыми ядерными.
Кроме того, если митохондрии встраиваются внутрь клеток и начинают там работать, то важно, чтобы они были в хорошей форме, не пострадали при путешествии по крови реципиента и точно достигли цели. С этим, возможно, получится справиться — если заключить органеллы в какую-нибудь капсулу из гидрогеля или даже приделать к ним наномотор, который будет сам вести их по сосудам в нужную точку. Но все еще остается проблема скорости.
При острых состояниях, вроде инфаркта или ишемии конечностей, важно действовать быстро. Едва ли получится собрать клетки, выделить из них митохондрии, обработать их и подсадить обратно. Хорошо бы иметь возможность в таком случае ввести в кровь пациенту готовый препарат митохондрий. Но это означает, что нет времени ни получить собственные митохондрии пациента, ни тщательно подобрать для него донора. Для быстрого реагирования нужен какой-то запас органелл от универсального донора — но неизвестно, удастся ли такого найти.
Универсальный донор был бы полезен еще и для того, чтобы сделать пересадку митохондрий доступнее и дешевле — особенно если кто-то рассчитывает применять ее при диабете, болезни Альцгеймера или других состояниях, связанных со старением. Если же понадобится каждый раз искать и выделять нужные органеллы, митохондрии рискуют остаться — даже если и эффективным, но — редким и дорогим лекарством, вроде генной или клеточной терапии, и едва ли станут социальным (во всех смыслах) препаратом.
Здоровый ли у вас метаболизм? Как проверить себя и как держать форму
Анализы, тесты, советы по образу жизни
Разрешено законом, запрещено ВкусВиллом
Гид по пищевым добавкам: как торговая сеть определяет, что может содержаться в продуктах на полках
Пять вещей, которые OpenClaw может сделать за вас прямо сейчас
Тестируем самую обсуждаемую ИИ-программу 2026 года


