Сколько времени? Как работают эпигенетические часы
Разбираем популярный маркер старения

Иллюстрация создана DALL-E
Эпигенетические часы — пожалуй, самый популярный способ узнать биологический возраст человека. Ими пользуются и исследователи старения, когда разрабатывают эксперименты на клетках или мышах, и биохакеры, которые ставят эксперименты сами на себе. Один из самых известных борцов за собственное долголетие, Брайан Джонсон, даже запустил соревнование по поддержанию эпигенетической молодости — Rejuvenation Olympics (и, кстати, пока не выигрывает его, хотя и держится в пятерке лидеров).
Принять участие в гонке несложно: достаточно сдавать кровь не реже трех раз в год. Сам же анализ — подсчет химических меток на ДНК внутри клеток — хоть и не дешевый, но доступен не только миллионерам. Гораздо сложнее понять, что означают его результаты.
Можно ли по эпигенетическим часам предсказать продолжительность жизни?
Короткий ответ: нет. Можно сделать только грубый прогноз без гарантий.
Подробнее: даже медицинские прогнозы — когда речь идет о человеке с конкретной стадией конкретной болезни — часто промахиваются. Что уж говорить о прогнозах по части долголетия: чтобы предсказать, когда человек умрет «от старости», пришлось бы суммировать прогнозы по множеству потенциальных причин смерти — возрастных болезней. Но эпигенетические часы вообще не измеряют течение никакой конкретной болезни. Их сила — в статистике.
Эпигенетические часы отслеживают количество и расположение метильных групп на ДНК в клетках человека. Это маленькие химические «наклейки», с помощью которых клетка в течение жизни размечает свой геном. Смысл их в том, что они сами или опосредованно делают ДНК менее активной, то есть мешают считывать с нее информацию. Иногда это идет клетке на пользу — например, бывает полезно «закрыть» какой-нибудь мобильный генетический элемент, который может выйти из-под контроля и начать самопроизвольно размножаться. Иногда — наоборот, во вред: например, если «закрылся» участок ДНК с нужным для клеточной жизни геном.
По мере старения оба процесса идут параллельно: на полезных участках метки появляются, а на вредных — теряются. И хотя довольно часто никто не знает, зачем клетке метилировать тот или иной конкретный кусок ДНК, точно известно, что с возрастом расположение эпигенетических меток меняется.
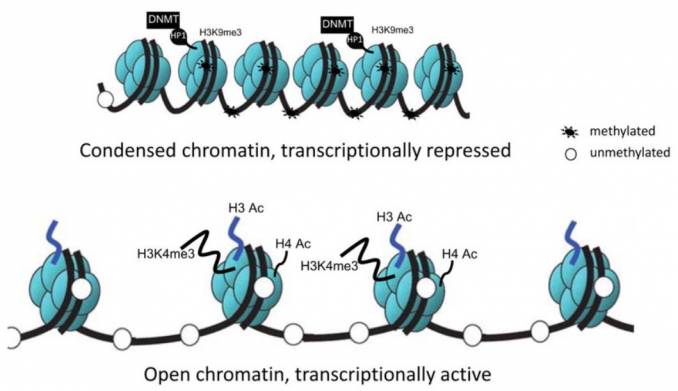
В 2013 году американец Стив Хорват выяснил, куда именно нужно смотреть: он выделил ключевые 353 позиции в ДНК, на которых со временем появляется или исчезает метильная группа. По этому набору он научился предсказывать хронологический (паспортный) возраст: если у большинства людей в возрасте Х лет метильные группы «висят» на определенных позициях ДНК, а перед нами еще один человек с такими же метильными группами, то можно предположить, что ему с большой вероятностью тоже Х лет.
Но эта вероятность не равна ста процентам. Отдельные люди выбиваются из закономерности — их эпигенетический возраст (определенный по часам Хорвата) не соответствует тому, что написано в паспорте. В таком случае предлагается решить, что их биологический возраст на самом деле больше или меньше хронологического. То есть состояние их организма больше напоминает состояние организма людей из другой возрастной категории.
Что это значит с медицинской точки зрения? Ничего конкретного. Единственный вывод, который здесь можно сделать — поскольку риск смерти у взрослых людей однозначно коррелирует с возрастом, такой человек рискует умереть от естественных причин больше или меньше, чем его сверстники. Откуда именно берется этот риск, непонятно, так как мы все еще не знаем, почему эти участки ДНК, на которых появляются метки, особенно важны для старения. Они даже, как позже заметил сам Хорват, связаны не со всеми признаками старения клеток. Поэтому эпигенетические часы не позволяют ничего понять про конкретные факторы риска, и уж тем более не дают точного прогноза. Они помогают только оценить состояние своего здоровья на фоне здоровья других людей.
Кто эти люди?
Короткий ответ: зависит от конкретных «часов».
Подробнее: эпигенетические часы — это не единый метод, а зонтичный термин, который включает в себя много разных моделей для определения биологического возраста. Каждая модель — это отдельный перечень позиций в ДНК, на которых исследователи ищут метильные метки. И каждый перечень ученые получили на отдельной выборке людей.
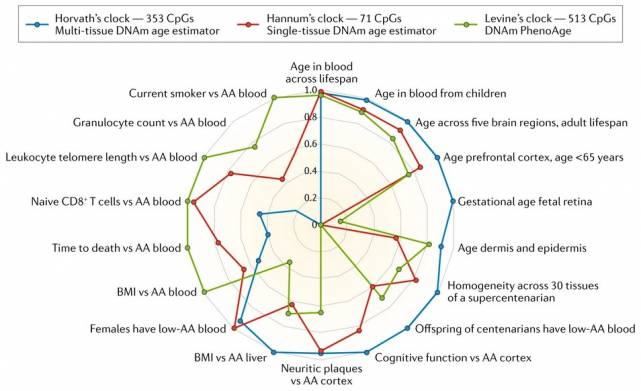
Сам Хорват в 2013 году анализировал данные по разным тканям, поэтому в его выборке встречаются и белые американцы, завещавшие свое тело науке (у них брали образцы мозга), и разновозрастные голландцы с шизофренией и без (для анализа крови), и новорожденные (как источники пуповинной крови), и пятнадцатилетние подростки (у них смотрели соскоб со щеки). Всего 82 разнородные группы.
Позже появились другие часы. Например, часы Ханнума — на выборке из 426 американцев и 230 латиноамериканцев. Или часы Левин (PhenoAge) — для них отобрали несколько тысяч человек, но снова американцев, из национального исследования NHANES. Позже Хорват доработал свою модель, новый вариант называется GrimAge. Он создан на основе выборки из Фрамингемского исследования сердца, это тоже несколько тысяч человек — но все жители Массачусетса, их потомки или партнеры.
Сейчас эпигенетических часов по меньшей мере десятки, и коммерческие лаборатории могут выбрать, с какими работать. Кто-то до сих пор меряет эпигенетический возраст «по Хорвату», используя его стартовый набор позиций на ДНК. Кто-то использует «Хорвата посвежее», другие придумывают свои собственные часы, и у каждой модели — своя выборка.
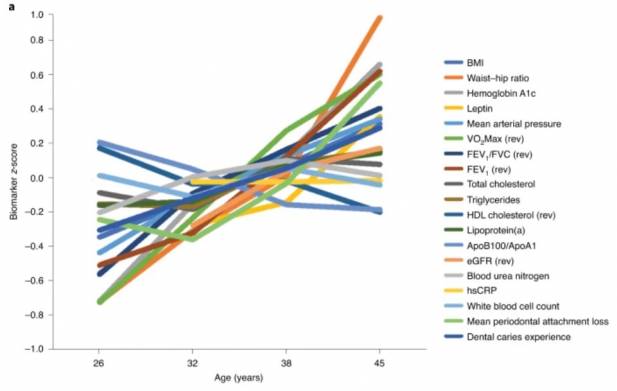
Брайан Джонсон и его соперники по Rejuvenation Olympics пользуются часами DunedinPACE. Их построили на основе выборки Данидинского исследования — у 1037 человек, рожденных в Данидине (на юге Новой Зеландии) в 1972-1973 годах, изучили метилирование в клетках крови в возрасте 26, 32, 38 и 45 лет. У такого подхода есть свои плюсы и свои минусы. С одной стороны, выборка очень ограничена по возрасту, и сложно рассчитывать, что часы будут хорошо работать за пределами этого диапазона. С другой стороны, сопоставлять результаты одного и того же человека и его сверстников в 26 и 45 может быть точнее, чем двух людей из разных поколений, которые могли расти в очень разных условиях.
Так что набор людей, с которыми вас будут сравнивать исследователи, определяя ваш эпигенетический возраст, зависит от того, какая именно модель в ходу в вашей лаборатории. И вас можно будет понять, если вы, вслед за учеными, которые упрекают создателей эпигенетических часов в нерепрезентативности выборок, зададитесь вопросом: точно ли эти люди образуют для меня хорошую линейку?
Тогда в чем смысл такого измерения?
Короткий ответ: можно следить не за абсолютным значением, а за динамикой.
Подробнее: во-первых, сложно сказать наверняка, насколько эпигенетические часы теряют точность вне своей выборки. Есть исследования, в которых они эту проверку прошли — например, оказалось, что некоторые из них, придуманные на американцах, все-таки работают для тайцев.
Во-вторых, всегда можно сравнивать себя с самим собой и отслеживать собственную динамику. К тому же, каждое следующее поколение эпигенетических часов точнее предыдущих, учитывает больше факторов и позволяет делать больше прогнозов (хотя они и остаются вероятностными).
Свои первые часы Хорват и Ханнум калибровали только по паспортному возрасту, то есть проверяли, насколько хорошо эпигенетический возраст соответствует хронологическому. Второе поколение часов — GrimAge, PhenoAge, DunedinPACE — устроено уже сложнее. Сначала исследователи создают суррогатный маркер биологического возраста: измеряют разные характеристики здоровья человека, вроде артериального давления или концентрации холестерина и С-реактивного белка в крови, и создают из них модель, которая предсказывает хронологический возраст или уровень смертности. А потом ищут такой набор меток на ДНК, который хорошо предсказывал бы вот этот суррогатный маркер.
Получается, что такие часы лучше валидированы — исследователи отобрали для них такие метки на ДНК, которые коррелируют не только с паспортным возрастом (средним по выборке), но и с физиологическими показателями. Кроме того, для каждой из модели со временем накапливаются подтверждающие исследования: ученые проверяют, способны ли часы предсказывать риск развития разных возрастных болезней (вроде диабета, инфаркта или болезни Альцгеймера). Поэтому в эпигенетических часах с каждым поколением и с каждым годом все больше биологического смысла — хотя о смысле каждой конкретной метильной метки все еще информации мало.
Точно ли можно по крови судить о болезнях других органов?
Короткий ответ: за неимением лучшего — можно.
Подробнее: этот вопрос задают себе и сами создатели эпигенетических часов. Дело в том, что все универсальные часы разрабатываются с прицелом именно на кровь, чтобы вместо множества анализов на разные физиологические характеристики можно было ограничиться одним тестом на легко доступном материале.
Но уверенного ответа на этот вопрос ни у кого нет. С одной стороны, все клетки тела подвержены возрастным изменениям. И если в организме развивается болезнь, то чаще всего — особенно если речь о возрастной патологии — она влияет сразу на несколько систем органов. Хотя бы потому что у большинства возрастных заболеваний есть воспалительная составляющая, а провоспалительные вещества и активированные лейкоциты легко путешествуют по организму.
С другой стороны, в большинстве случаев какая-то одна ткань или орган страдает сильнее прочих. И логично представить, что возраст ее клеток может отличаться от других. Причем в разные стороны — раковые клетки, например, могут быть моложе здоровых соседей. В таком случае кровь не может служить хорошим отражением ситуации в организме. К подобным выводам ученые уже неоднократно приходили, изучая другие маркеры биологического возраста. То же оказалось верно и для эпигенетических часов.
Хорошим решением здесь были бы часы, которые учитывали бы сразу все возможные органы. И ученые движутся в этом направлении — год назад большая коллаборация под руководством все того же Хорвата сделала модель, которая работает на разных тканях, причем не только человеческих, но и других млекопитающих. Но это пока сугубо фундаментальное достижение. Такие модели нужно будет еще тщательно калибровать, прежде чем «пускать» их к людям. И проверять, что они показывают нужный результат именно на клетках крови — потому что в коммерческих лабораториях едва ли согласятся работать с какими-то другими тканями.
Эти часы показывают только старение? Или омоложение тоже можно увидеть?
Короткий ответ: увидеть можно, но неизвестно, точно ли это именно оно.
Подробнее: примеров того, когда в эксперименте ученые фиксировали омоложение — то есть у одного и того же человека возраст со временем становился меньше, — немного, но они есть.
Об одном из них мы уже рассказывали: в 2019 году Стив Хорват вместе с коллегами провел исследование по восстановлению тимуса. Это иммунный орган размером со спичечный коробок, который у молодых людей расположен в области грудины и производит Т-лимфоциты, но с возрастом почти полностью замещается жиром. Соавторы Хорвата отобрали девять добровольцев и давали им три препарата: гормон роста, метформин (лекарство от диабета второго типа, которое в последние годы очень популярно и у исследователей старения, и у биохакеров) и дигидроэпиандростерон, предшественник гормонов надпочечников. За год такой терапии у большинства добровольцев действительно восстановилась часть тимуса, а средний эпигенетический возраст оказался на полтора года меньше ожидаемого — то есть на два с половиной года меньше, чем в начале эксперимента.
Но к этому результату есть вопросы. Дело в том, что эпигенетический возраст Хорват и его коллеги определяли как среднее для множества клеток из венозной крови. А кровь, как и многие ткани, состоит из разных клеточных типов: среди них есть более молодые и более старые, и есть стволовые, которые делятся и дают начало новым молодым. Можно себе представить ситуацию, в которой в крови просто изменилось соотношение: старые клетки исчезли (допустим, их переработали в селезенке), а стволовые начали активнее делиться, поэтому молодых стало больше. (Некоторые ученые, кстати, замечали, что соотношение клеток в крови колеблется даже в течение суток — и эпигенетический возраст вместе с ним.) В таком случае кровь в целом действительно стала моложе, но конкретные клетки — не стали.
С точки зрения пользователя разница, конечно, невелика. Если в крови стало больше молодых клеток, то она как система стала работать лучше — и так ли важно, каким путем достигнут этот результат? Но для биологов это вопрос принципиальный. Это вопрос о том, произошло ли в эксперименте омоложение отдельных клеток. А то может оказаться, что в соревновании Rejuvenation Olympics собственно о rejuvenation говорить и не приходится.
А клетка вообще может стать моложе?
Короткий ответ: похоже, что может. Но у взрослого человека — не факт.
Подробнее: эксперимент, который бы подтвердил, что у конкретной клетки снижается эпигенетический возраст, поставить довольно сложно — для этого нужно научиться следить за метилированием ДНК in vivo. Но есть две ситуации, в которых ученые предполагают, что омоложение отдельных клеток все-таки происходит.
Первая — это ранние зародыши млекопитающих. Логично предположить, что какой-то процесс омоложения в них должен идти, поскольку к моменту оплодотворения и яйцеклетка, и сперматозоид уже немолоды. Если бы их возраст никак не «обнулялся», то получалось бы, что каждое следующее поколение начинает жизнь не с нуля, и значит, стареет быстрее или живет короче предыдущего. А поскольку это не так, значит, после оплодотворения эпигенетические метки куда-то деваются. И действительно, в нескольких экспериментах группа гарвардского исследователя Вадима Гладышева подсчитала, что эпигенетический возраст зародышей человека достигает нуля (ground zero point of aging) примерно через две недели развития. Но как именно это происходит, пока никто не выяснил.
Вторая ситуация — это уже не естественное омоложение, а искусственное, с помощью технологии репрограммирования. Этот метод придумали японские биологи Яманака и Такахаши в начале 2000-х годов. Суть его в том, что каждая клетка, которая превращается из стволовой в специализированную, «закрывает» ненужную часть ДНК (например, нейрону не нужно иметь возможность производить гемоглобин). А значит, если снять метки с ДНК, то почти любую клетку взрослого организма можно превратить в стволовую. Яманака и Такахаши подобрали четыре гена (и соответствующих им белка, факторы Яманаки), которые запускают раскручивание ДНК и удаление лишних метильных групп, в результате чего клетка теряет специализацию и возвращается в состояние эмбриональной. Эпигенетический возраст при этом, как оказалось, тоже снижается.
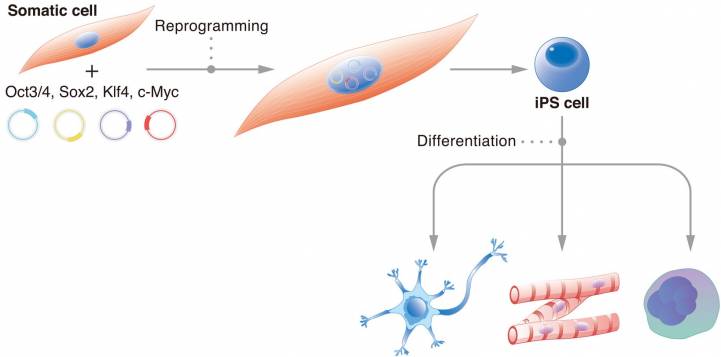
Можно ли омолаживать людей (или хотя бы мышей) с помощью репрограммирования — пока вопрос открытый. Проблема в том, что факторы Яманаки сложно ввести во все клетки организма или даже органа одновременно. Удобнее всего это делать с помощью генетической модификации, но к людям это не применимо. Кроме того, работу факторов Яманаки нужно вовремя остановить — иначе клетки не только станут моложе, но и потеряют специализацию, и тогда органы перестанут работать. Этого ученые тоже пока умеют добиваться только с помощью генетических переключателей.
Над омоложением с помощью репрограммирования сейчас работает параллельно множество команд. Самые крупные из них — из компании CalicoLabs, которую спонсирует Google, и Altos Labs, в которую инвестировали Джефф Безос и Юрий Мильнер. Ни та, ни другая пока не перешли к экспериментам на человеке и даже не обещают, что перейдут, хотя от них, безусловно, многие этого ждут.
Но и в теоретической части здесь остается много нерешенных вопросов: как работает омоложение? Похожи ли эти процессы у зародышей и при репрограммировании? И достаточно ли «открутить» эпигенетические часы, чтобы добиться омоложения у взрослого человека? Все это еще предстоит выяснить — и тогда, вероятно, мы поймем, как на самом деле работают эпигенетические часы и что именно они измеряют.
Не можете сосредоточиться? Возможно, дело в завтраке
Исследование показывает, что сахар с утра может замедлять мышление и затруднять самоорганизацию
Разрешено законом, запрещено ВкусВиллом
Гид по пищевым добавкам: как торговая сеть определяет, что может содержаться в продуктах на полках
От 20 до 80: пошаговый гид по тренировкам для долголетия
Как меняются правила фитнеса с возрастом


